北海道・札幌の工藤くんと共著で潜水士合格のための受験本を書いている。去年2014年に初版がでた。
2014年4月に高気圧作業安全衛生規則 が改定になった。折もよく、僕たちの受験本も売り切れて、増刷できることになった。もちろん、規則改定に合わせて、こちらも改訂しなくてはならない。元々は過去問の解説を中心とした本なのだが、規則改定以来の過去問がない。
しかし、なんとか改訂して増刷しなければ、終わってしまう。
今回の改正の中心は、①潜水計画の方、そしてその記録を5年間保存しておかなくてはならないこと、②減圧表が規則から削除されて、代わりに減圧理論が規則に載せられた。
改訂する本の一部の原稿を中心にしてこの問題を考えて、みよう。「 」は、本文の原稿、(未定稿) である。
「 高圧則に掲載されている 減圧理論とは、計算式である。
M値の計算式
![]()
M値の算出は、①の16半飽和組織分、浮上停止予定の水深ごとに
算出します。
・M M値
・Pa 大気圧 100kPa ※水蒸気圧5.67kPaを考慮し、差し引いた94.33kPaが望ましいです。
・Pc 圧変化後の環境圧力(ゲージ圧、kPa)※現在水深からの浮上先水深または水面のゲージ圧です。
・A ①の窒素a値
・B ①の窒素b値」
人間を理系と文系に分類するのはまちがい、という説もあるけれど、計算式を見ただけで、「もうダメ」という人類は確実に存在している。
僕もその一人である。ダイバーの多くは、計算式ダメ人間だろうと思う。そのダメ人間にこの式が示す意味を、文系的に説明しなければならない。いや、説明の前に文系的に理解しなければならない。
計算式とは、素晴らしいもので、これから、延々と書こうとすることを、上の式だけで表している。だから、規則に載せるのは、計算式だけで良い。のだが、ダイビング関係者で理解ができているのは、理系の研究者は別として、数えるほどだろう。
理解できる人に説明してもらっても、その説明が僕に容易に理解できないということだ。何処がわからないのかわからないわけだから、困る。しかし、なんとか、文系的表現で理解できる限界まで理解してみよう。
少し長くなるので、何回かに分けるかもしれない。結論は、できれば、400字くらいにまとめなくてはいけないのだが。自分の思考過程を確認しておく作業である。
知的な文章を書こうとする時、言い訳の文章を書いてはいけないというが、それは本にする、論文にするような時のことで、ブログは自由と決めている。
まず、人間、ダイバーが次第に深く潜って行くと、身体にかかる水圧(環境圧)が増加する。呼吸する気体の圧力も環境圧と等しいからこれも増加する。呼吸するカス圧が高くなると、血流に溶け込むガスの圧も高くなる。気体と液体が接すると、気体の圧に比例して、液体の中にガスが溶けこんで行く。これをヘンリーの法則という。此処から先が文系人間には理解し難い。僕も危ない。比例してガスの量が増えると言ってもそのガスの量の単位は何で表現されるのか?重さ、キログラムだろうか、長さ、cmだろうか、長さとか重さは人間が見たり、持ち上げたりすることで感覚的に受け止めることができる。溶け込むガスの量は重さでも長さ(大きさ)でもなく、圧力で示される。圧力は感じることはできるけれど、見ることはできない。
それも、身体にかかる重さとしての圧力は感じることができるが、身体の中に溶け込むガスの圧力を物理的に感じることができない。その変化による生理学的な影響、変化は感じることができる。ダイバーならば、窒素酔いがそれに当たることを知っている。
身体の中に溶け込む気体の量は、圧力で測られ、示される。ダイバーに対する生理的な影響として、ここで考えるのは、まず空気の80%を占めている窒素である。空気中の窒素の量は、窒素だけの圧力、分圧で表される。大気圧、1気圧の中での窒素はその80%だから、0.8気圧である。これがドルトンの分圧の法則であり、ダイバーが知らなくてはならない、3番目ぐらいの法則である。ボイルの圧力の法則、ヘンリーの溶解の法則、そしてドルトンの分圧の法則、何れも圧力に関係する法則である。潜るということは、圧力との対決だから、この三つは知らないとC-カードもあげられない。潜水士にもなれない。今使われている圧力単位は、パスカルで、大気圧、1atm. は、100kPa(キロパスカル)である。
まず問題にしているのは窒素で、窒素は不活性ガスだから、身体に溶け込んだ窒素の量は不活性ガス分圧で、示される。水深40mに潜ったとすると、身体にかかる圧力(絶対圧)は、5気圧であり、500kPaである。その内で、窒素、不活性ガス分圧は、400kPaである。今度の規則改正で窒素の分圧、400kPaを越えて潜ってはいけないことになった。空気を呼吸して40m以上潜ってはいけないのだ。どうするかというと、無害で、軽いヘリウムという不活性ガスを混合させて、窒素400kPaを維持する。60m潜ると、全圧は700kPa、酸素を20%として、140kPa、窒素は400kPaで留めるから、残りの160kPaをヘリウムにしなければならない。なお、酸素も酸素中毒を起こすので、160kPaを超えてはいけないと、これも高圧則で定められている。酸素20%では、70mで限界に達するから、70m以上もぐるのであれば、例えば、酸素10%で、80kPa。窒素を400kPa、ヘリウムが320kPaの混合ガス、三種混合だからトライミクスで呼吸する事になる。このくらいまでは暗算でできることが潜水士としては要求される。僕でもできる?ちょっと電卓を持ってこないと心配。
とりあえず、40m潜ることにして、呼吸するガスの窒素分圧は400kPaである。普通に暮らしている大気圧での窒素分圧は80kPa、酸素が20kPaで、合計は100kPaである。
窒素分圧で400:80だが、潜った瞬間に体の中の窒素が400になるわけではなくて、80から時間経過とともに次第に400に近づいて行く。体の中が400になると、もうそれ以上は溶けこんで行かない。これを飽和という。
高圧則で採用している理論式、ビュールマン教授の理論では、この溶け込み方、および浮上の時の溶け出し方について、指数関数的としている。指数関数的とは、階段を上がるように、下るようにということで、例えば飽和の半分、半飽和までが10分とする。すなわち、10分経過で50%溶け込む。次の10分で残りの50%が溶け込んで100%になる。そうは行かないというのが指数関数で、次の10分では残りの50%の半分25%が溶け込んで、75%が溶け込む事になる。その次の10分では25%の半分だから12.5%、87.5%が溶け込んだことになる。半分の半分をくりかえすと無限の時間がかかるから、とりあえず、6回の繰り返しで、ほぼ100%が溶け込む、窒素については、400kPaで飽和する、10分で半分だったから、60分で飽和に達することになる。
身体の中の組織は一様ではない。血液、皮膚、筋肉、内蔵、脳、脊椎、骨、等様々である。
それをビュールマン教授の理論では、16通りに分けることにしている。飽和の半分、半飽和時間を5分から635分までの16通りである。これはあくまでも計算のための分類であり、肝臓は何分、胃は何分という指定はない。概して言えば、血流の多いガスの入れ替わりの速い、筋肉などは短く、脊椎など身体の芯で脂肪分が多く血流に少ない部分は長くなる。
例えば半飽和時間が最短の5分の組織では、5分の6回、30分で飽和に達することになる。この組織の呼び名としては、半飽和時間5分の組織、略して5分の半飽和組織という事になる。
潜水士のテキストでは、5分の半飽和組織を第一、635分を、第16半飽和組織とよんでいる。これを、英語ではコンパートメント(区切り)と呼んだりしている。635分のコンパートメントでは、635×6=3810分、63,5時間で飽和する。完全に溶け出すのも635時間かかることになる。
つづく
2014年4月に高気圧作業安全衛生規則 が改定になった。折もよく、僕たちの受験本も売り切れて、増刷できることになった。もちろん、規則改定に合わせて、こちらも改訂しなくてはならない。元々は過去問の解説を中心とした本なのだが、規則改定以来の過去問がない。
しかし、なんとか改訂して増刷しなければ、終わってしまう。
今回の改正の中心は、①潜水計画の方、そしてその記録を5年間保存しておかなくてはならないこと、②減圧表が規則から削除されて、代わりに減圧理論が規則に載せられた。
改訂する本の一部の原稿を中心にしてこの問題を考えて、みよう。「 」は、本文の原稿、(未定稿) である。
「 高圧則に掲載されている 減圧理論とは、計算式である。
M値の計算式
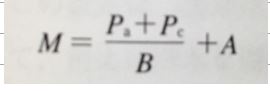
M値の算出は、①の16半飽和組織分、浮上停止予定の水深ごとに
算出します。
・M M値
・Pa 大気圧 100kPa ※水蒸気圧5.67kPaを考慮し、差し引いた94.33kPaが望ましいです。
・Pc 圧変化後の環境圧力(ゲージ圧、kPa)※現在水深からの浮上先水深または水面のゲージ圧です。
・A ①の窒素a値
・B ①の窒素b値」
人間を理系と文系に分類するのはまちがい、という説もあるけれど、計算式を見ただけで、「もうダメ」という人類は確実に存在している。
僕もその一人である。ダイバーの多くは、計算式ダメ人間だろうと思う。そのダメ人間にこの式が示す意味を、文系的に説明しなければならない。いや、説明の前に文系的に理解しなければならない。
計算式とは、素晴らしいもので、これから、延々と書こうとすることを、上の式だけで表している。だから、規則に載せるのは、計算式だけで良い。のだが、ダイビング関係者で理解ができているのは、理系の研究者は別として、数えるほどだろう。
理解できる人に説明してもらっても、その説明が僕に容易に理解できないということだ。何処がわからないのかわからないわけだから、困る。しかし、なんとか、文系的表現で理解できる限界まで理解してみよう。
少し長くなるので、何回かに分けるかもしれない。結論は、できれば、400字くらいにまとめなくてはいけないのだが。自分の思考過程を確認しておく作業である。
知的な文章を書こうとする時、言い訳の文章を書いてはいけないというが、それは本にする、論文にするような時のことで、ブログは自由と決めている。
まず、人間、ダイバーが次第に深く潜って行くと、身体にかかる水圧(環境圧)が増加する。呼吸する気体の圧力も環境圧と等しいからこれも増加する。呼吸するカス圧が高くなると、血流に溶け込むガスの圧も高くなる。気体と液体が接すると、気体の圧に比例して、液体の中にガスが溶けこんで行く。これをヘンリーの法則という。此処から先が文系人間には理解し難い。僕も危ない。比例してガスの量が増えると言ってもそのガスの量の単位は何で表現されるのか?重さ、キログラムだろうか、長さ、cmだろうか、長さとか重さは人間が見たり、持ち上げたりすることで感覚的に受け止めることができる。溶け込むガスの量は重さでも長さ(大きさ)でもなく、圧力で示される。圧力は感じることはできるけれど、見ることはできない。
それも、身体にかかる重さとしての圧力は感じることができるが、身体の中に溶け込むガスの圧力を物理的に感じることができない。その変化による生理学的な影響、変化は感じることができる。ダイバーならば、窒素酔いがそれに当たることを知っている。
身体の中に溶け込む気体の量は、圧力で測られ、示される。ダイバーに対する生理的な影響として、ここで考えるのは、まず空気の80%を占めている窒素である。空気中の窒素の量は、窒素だけの圧力、分圧で表される。大気圧、1気圧の中での窒素はその80%だから、0.8気圧である。これがドルトンの分圧の法則であり、ダイバーが知らなくてはならない、3番目ぐらいの法則である。ボイルの圧力の法則、ヘンリーの溶解の法則、そしてドルトンの分圧の法則、何れも圧力に関係する法則である。潜るということは、圧力との対決だから、この三つは知らないとC-カードもあげられない。潜水士にもなれない。今使われている圧力単位は、パスカルで、大気圧、1atm. は、100kPa(キロパスカル)である。
まず問題にしているのは窒素で、窒素は不活性ガスだから、身体に溶け込んだ窒素の量は不活性ガス分圧で、示される。水深40mに潜ったとすると、身体にかかる圧力(絶対圧)は、5気圧であり、500kPaである。その内で、窒素、不活性ガス分圧は、400kPaである。今度の規則改正で窒素の分圧、400kPaを越えて潜ってはいけないことになった。空気を呼吸して40m以上潜ってはいけないのだ。どうするかというと、無害で、軽いヘリウムという不活性ガスを混合させて、窒素400kPaを維持する。60m潜ると、全圧は700kPa、酸素を20%として、140kPa、窒素は400kPaで留めるから、残りの160kPaをヘリウムにしなければならない。なお、酸素も酸素中毒を起こすので、160kPaを超えてはいけないと、これも高圧則で定められている。酸素20%では、70mで限界に達するから、70m以上もぐるのであれば、例えば、酸素10%で、80kPa。窒素を400kPa、ヘリウムが320kPaの混合ガス、三種混合だからトライミクスで呼吸する事になる。このくらいまでは暗算でできることが潜水士としては要求される。僕でもできる?ちょっと電卓を持ってこないと心配。
とりあえず、40m潜ることにして、呼吸するガスの窒素分圧は400kPaである。普通に暮らしている大気圧での窒素分圧は80kPa、酸素が20kPaで、合計は100kPaである。
窒素分圧で400:80だが、潜った瞬間に体の中の窒素が400になるわけではなくて、80から時間経過とともに次第に400に近づいて行く。体の中が400になると、もうそれ以上は溶けこんで行かない。これを飽和という。
高圧則で採用している理論式、ビュールマン教授の理論では、この溶け込み方、および浮上の時の溶け出し方について、指数関数的としている。指数関数的とは、階段を上がるように、下るようにということで、例えば飽和の半分、半飽和までが10分とする。すなわち、10分経過で50%溶け込む。次の10分で残りの50%が溶け込んで100%になる。そうは行かないというのが指数関数で、次の10分では残りの50%の半分25%が溶け込んで、75%が溶け込む事になる。その次の10分では25%の半分だから12.5%、87.5%が溶け込んだことになる。半分の半分をくりかえすと無限の時間がかかるから、とりあえず、6回の繰り返しで、ほぼ100%が溶け込む、窒素については、400kPaで飽和する、10分で半分だったから、60分で飽和に達することになる。
身体の中の組織は一様ではない。血液、皮膚、筋肉、内蔵、脳、脊椎、骨、等様々である。
それをビュールマン教授の理論では、16通りに分けることにしている。飽和の半分、半飽和時間を5分から635分までの16通りである。これはあくまでも計算のための分類であり、肝臓は何分、胃は何分という指定はない。概して言えば、血流の多いガスの入れ替わりの速い、筋肉などは短く、脊椎など身体の芯で脂肪分が多く血流に少ない部分は長くなる。
例えば半飽和時間が最短の5分の組織では、5分の6回、30分で飽和に達することになる。この組織の呼び名としては、半飽和時間5分の組織、略して5分の半飽和組織という事になる。
潜水士のテキストでは、5分の半飽和組織を第一、635分を、第16半飽和組織とよんでいる。これを、英語ではコンパートメント(区切り)と呼んだりしている。635分のコンパートメントでは、635×6=3810分、63,5時間で飽和する。完全に溶け出すのも635時間かかることになる。
つづく